азоту оксиди
Аз про та про кислі, сполуки азоту з киснем. Відомі N2O, NO, N2O3, NO2 (і його димер N2O4), N2O5; є відомості про існування NO3, що не виділеного в вільному стані. При високій температурі в полум'ї вольтової дуги, а в природі - при електророзряд з суміші азоту з киснем утворюється окис азоту NO, яка при охолодженні переходить в NO2. Інші А. о. отримують непрямим шляхом. N2O5 - тверда речовина; інші оксиди при звичайних умовах газоподібні.
Закис азоту N2O - безбарвний газ із слабким приємним запахом і солодкуватим смаком; вдихання суміші повітря з N2O викликає стан, що нагадує сп'яніння (звідси назва - звеселяючий газ). Щільність при 0 ° С і 101 325 н.е. / м2 (760 мм рт. Ст.) 1,9804 кг / м3, t кип - 89,5 ° С, t пл - 102,4 ° С. 1 обсяг N2O при 5 ° C розчиняє 1,048 обсягу N2O. Хімічно N2O з водою, розчинами кислот і лугів не реагує, кисень не окислюється. Вище 500 ° C розкладається: 2N2O = 2N2 + O2; тому при підвищених температурах діє як сильний окислювач і підтримує горіння. Отримують N2O термічним розкладанням нітрату амонію: NH4NO3 = N2O + 2H2O. У медицині служить для загальної анестезії.
Окис азоту NO - безбарвний газ, буріючі при зіткненні з повітрям внаслідок окислення до NO2. Щільність при 0 ° С і 101 325 н.е. / м2 (760 мм рт ст) 1,3402 кг / м3, t кип-151,8 ° С, t пл - 163,6 ° С. У воді мало розчинна (0,0738 обсягу в 1 об'ємі H2Oпрі 0 ° С). З водою, кислотами і лугами хімічно не взаємодіє. Утворює численні продукти приєднання, наприклад нітрозілхлорід NOCI. Отримують NO дією розведеної азотної кислоти на деякі метали, наприклад: 3Cu + 8HNO3 = 3Cu (NO3) 2 + 4H2O + 2NO. Окис азоту - важливий напівпродукт окислення аміаку при отриманні азотної кислоти .
Азотистий ангідрид (трехокісь азоту) N2O3 - в звичайних умовах нестійке з'єднання. Розкладається вже при 0 ° С:
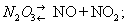
Близько 3,5 ° С кипить з розкладанням, при 25 ° C містить тільки 10% недиссоциированного N2O3. При низькій температурі може бути отриманий у вигляді темно-блакитний рідини, при сильному охолодженні - світло-блакитний маси з tпл - 102 ° С. З водою утворює азотної кислоти : N2O3 + H2O = 2HNO2, з лугами - солі (див. нітрити ) .N2O3 отримують по реакції: N2O4 + 2NO = 2N2O3; практичного застосування не знаходить.
Двоокис азоту NO2 - бурий газ з задушливим запахом, при 21,15 ° C - буро-червона рідина, бліднуть при подальшому охолодженні через утворення четирёхокісі азоту N2O4, tотв -11,2 ° С. Взаємодіє з водою з утворенням азотної кислоти і окису азоту: 3NO2 + H2O = 2HNO3 + NO; з лугами утворює нітрати і нітрити. Двоокис азоту - сильний окислювач; в струмі NO2 енергійно згорають вугілля, сірка, фосфор, органічні сполуки. У промисловості NO2 отримують окисленням NO при виробництві азотної кислоти, в лабораторії - термічним розкладанням деяких нітратів: 2Pb (NO3) 2 = 2PbO + O2 + 4NO2. Застосовують NO2 як нітрит агент (див. нітрування органічних сполук).
Азотний ангідрид (пятиокись азоту) N2O5 - безбарвні дуже летючі кристали. Вкрай нестійкий і вибухонебезпечний. Взаємодіє з водою, даючи азотну кислоту: N2O5 + Н2O = 2HNO3, з лугами утворює солі - нітрати . В лабораторії отримують по реакції: 2HNO3 + P2O5 = N2O5 + 2HPO3. Практичного застосування не знаходить. Все А. о. фізіологічно активні.
Літ. см. при ст. азот , Азотна кислота .
